تهیه فیلم های نازک آبی پروس الکتروکرومیک
kimiagaranjavan-co.com
تهیه فیلم های نازک آبی پروس الکتروکرومیک
خلاصه تهیه فیلم های نازک آبی پروس الکتروکرومیک
30/خرداد/1398
مقدمه
آبی پروس(PB)، رنگدانه بسیار مهمی است که حدود 300 سال قبل توسط شیمیدان ها ساخته شد و در طی سالیان متمادی از آن در رنگ آمیزی، نقاشی، جوهرهای چاپ و تمبر وغیرهبه وفور استفاده شده است. این رنگدانه در شیمی تجزیه کلاسیک کیفی و تست های فوری آهن و نیتروژن در ترکیبات آلی، تهیه زیست حسگرهای آنزیمی و زیست حسگرهای چاپ اسکرین نیز مورد استفاده قرار گرفته است. اخیرا جوهرهایی از نانو ذرات PB محلول در آب و محلول در حلال آلی به وسیله اصلاح سطح بلورهای PB با یون های [Fe(CN)6]4- و اولی آمین به دست آمده اند. جوهرهای نانو مشابهی از نیکل هگزاسیانوفرات های زرد رنگ و کبالت هگزا سیانو فرات های قرمز رنگ نیز با استفاده از رنگدانه PB آبی رنگ تهیه شده اند.
به کمک این نانو جوهرها به عنوان رنگ های اولیه و با مخلوط کردن آنها رنگ های مختلفی به دست آمده است و پیش بینی می شود که از جوهرهای نانو PB در آینده به وفور در صنعت لیتوگرافی و فوتولیتوگرافی استفاده شود.
برای PB دو فرمول شناخته شده "PB نامحلول در آب" و "PB محلول در آب" پیشنهاد شده، که با استفاده از مشاهدات طیفی مادون قرمز، رزونانس موزباور و طیف های جذبی نوری به طور واضح رنگدانه آهن (III) هگزاسیانوفرات(II) نشان داده شده است.همچنین نشان داده شده است که اکسیداسیون و احیاءی شیمیایی PB می تواند به ترتیب به سفید پروس و سبز پروس منجر شود.
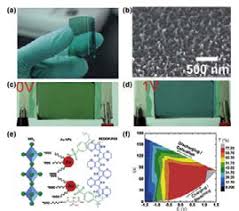
از بین آزمایشهای الکترو شیمیایی، آزمایش رفتار الکتروکرومیک PB ترسیبی بر روی یک الکترود شفاف برای دانشجویان از جذابیت ویژه ای برخوردار است. تغییرات رنگ ناشی از فرایندهای اکسیداسیون و احیاءی آبی پروس(فریک فروسیانید) به نحوی است که آن را ماده ماده الکتروکرومیک می نامند. مشاهده چنین تغییرات رنگی در طی ولتامتری چرخه ای این رنگدانه بسته به نسبت حالت اکسید شده به احیاء شده بر روی الکترود با پتانسیل اعمالی (معادله نرنست) به معرفی کیفی مباحث الکترو شیمیایی نیز کمک بسزایی می کند. از این رو، اگر این رنگدانه ترسیبی در محیط آبی و در حضور یون های پتاسیم احیاء شود، فیلم بی رنگ می شود که نمک اوریت(ES) نامیده می شود. چنانچه در محیط کلریدی اکسیداسیون صورت بگیرد، ترکیب زرد رنگ معروف به زرد پروس (PY) به دست می آید.
با وجود اینکه در ابتدا فیلم های PB ترسیب شده به شکل نامحلول هستند، اما هنگامیکه فیلم ها در محلوهای آبی حاوی یون های پتاسیم چندین بار توسط ولتامتری چرخه ای تحت اکسیداسیون و احیاء قرار گیرند (چرخه زده شود) یک تغییر ساختاری در ماده ایجاد می شود. بدین طریق حدود یک چهارم Fe در ساختار کاهش یافته و در واقع برای خنثی ماندن الکترونی فیلم این مقدار Fe به وسیله یونهای پتاسیم جایگزین می شود. این ساختار دوم آبی پروس "آبی پروس محلول" نامیده می شود. این تغییر را می توان به وسیله تغییر در پیک های ولتامتری که بلندتر و باریکتر می باشند، مشاهده کرد. اما خواص الکترو کرومیک فیلم ها محفوظ مانده و هنگام اکسیداسیون و احیاءی فیلم های PB تغییرات رنگ مشابهی دیده می شود. مطالعات بر روی پایداری این ماده ثابت کرده است که چنانچه در ابتدا چندین بار پیرامون سیستم PB=ES (سیستم احیاء) چرخه زده شود، پایداری فیلم ها افزایش می یابد.
در این آزمایش K3[Fe(III)(CN)6] به طریق الکتروشیمیایی در یک الکترود شیشه ای برای تولید K4[Fe(II)(CN)6] احیاء می شود. K4[Fe(II)(CN)6] در الکترود با Fe(III)Cl3 در محلول واکنش داده و بر روی الکترود، آبی پروس نامحلول Fe(III)[Fe(II)(CN)6]3 را می دهد. پوشش روی شیشه با اعمال ولتاژ تغییر رنگ داده و لایه ای به ضخامت تقریبا nm100 الکتروکرومیسم مرئی را به معرض نمایش قرار می دهد.
مواد و وسایل مورد نیاز
مواد لازم:
محلول 05/0 مولار HCl: از رقیق کردن 5 میلی لیتر HCl غلیظ در 250 میلی لیتر آب بدست می آید.
محلول 05/0 مولار K3[Fe(CN)6]: از حل کردن 65/1 گرم K3[Fe(CN)6] در 100 میلی لیتر آب بدست می آید.
محلول 05/0 مولار FeCl3.6H2O: از حل کردن 35/1 گرم FeCl3.6H2O در 100 میلی لیتر آب و یک قطره HCl به دست می آید.
محلول 1 مولار KCl: از حل کردن 6/18 گرم KCl در 250 میلی لیتر آب و دو قطره HCl به منظور کاهش PH به دست می آید.
وسایل:
بشر 50 میلی لیتر، شیشه رسانا (با ضخامت 3/2 میلی متر و ابعاد 5/2*5/2 سانتی متر)، اهم متر، سیم پلاتینی یا الکترود گرافیتی، باتری 5/1 ولت، جاباتری، مقاومت متغیر 50 کیلو اهم برای کنترل جریان ترسیب، دستگاه الکتروشیمیایی برای به دست آوردن ولتاموگرام های چرخه ای.
روش کار
- به ترتیب 5 میلی لیتر از محلول 05/0 مولار HCl، 10 میلی لیتر از محلول 05/0 مولار K3[Fe(CN)6] و 10میلی لیتر از محلول 05/0 مولار FeCl3.6H2O به یک بشر 0 میلی لیتری اضافه کنید. این محلول مخلوط بایستی درست قبل از استفاده تهیه شود.
- طرف رسانای یک قطعه شیشه پوشیده شده از قلع اکسید را با استفاده از مولتی متر برای اندازه گیری مقاومت مشخص نمایید. طرف رسانا مقاومتی در حدود 20 تا 30 اهم خواهد داشت.
- طرف رسانای شیشه را به سمت یک حلقه ای از الکترود سیم پلاتین یا الکترود گرافیت قرار دهید. قطب منفی یک منبع پتانسیل را به شیشه و قطب مثبت را به الکترود سیم پلاتین یا الکترود گرافیت متصل نمایید. الکترودها (اما نه گیره سوسماری ها) را به داخل محلول تهیه شده از قبل فرو ببرید و به سرعت ولتاژ را تنظیم کنید تا در مدت 60 ثانیه جریان 40 موA بر سانتی متر مربع عبور کند.
- الکترود را با آب دوبار تقطیر بشویید. پس از 60 ثانیه حدود 50 نانومتر پوشش(محاسبه شده) بر سطح رسانا تشکیل می شود که با چشم قابل مشاهده است.
- در زمان های طولانی تر الکترولیز، پوشش های با ضخامت بیشتر به دست می آید. پس از عبور جریان 80 موA به مدت 30 ثانیه الکترود شسته می شود تا تغییر رنگ مشخص شود. مراحل شستشو پس از 30 ثانیه تکرار می شود تا تغییر رنگ نشان داده شود. کل زمان لازم برای رسیدن به پوشش نسبتا ضخیم 300 ثانیه است.
- الکترودهای شسته شده را در 25 میلی لیتر از محلول 0/1 مولار KCl قرار دهید و گیره را بالای محلول نگه دارید. تغییر در ولتاژ اعمال شده باعث تغییرات رنگ فیلم نازک می شود.
- یا ولتاموگرام چرخه ای شیشه پوشیده شده را به دست آورید و یا باتری را از مدار خارج ساخته و به جای آن به صورت زیر به الکترودها متصل نمایید:
الف- الکترود شیشه را به قطب منفی باتری و الکترود پلاتین یا گرافیت را به قطب مثبت باتری متصل کنید. پتانسیل منفی به الکترود شیشه اعمال می شود.
ب- الکترود شیشه را مستقیما به الکترود گرافیت یا پلاتین متصل کنید. پتانسیل صفر اعمال می شود.
بر طبق مشاهدات و گزارشات موجود چنانچه مراحل الف و ب چندین مرتبه تکرار شود، فیلم ها پایدارتر می شوند.
ج- الکترود شیشه را به قطب مثبت باتری و الکترود گرافیت یا پلاتین را به قطب منفی باتری متصل کنید. پتانسیل مثبت به الکترود شیشه اعمال می شود.
د- الکترود شیشه را مستقیما به الکترود گرافیت یا پلاتین متصل کنید. پتانسیل صفر اعمال می شود.
ه- تکرار کنید.
همانطوری که مشاهده می شود محصول واکنش احیاء بی رنگ و محصول واکن اکسایش زرد رنگ می باشد.
- ولتاموگرام چرخه ای شیشه پوشیده شده را با سرعت پیمایش mV/sec20 از mV50+ تا mV250- تا mV1200+ تا mV550+ برحسب الکترود مرجع Ag/AgCl ثبت نمایید. وقتی ولتاژ به اندازه پتانسیل لازم برای انجام یک واکنش ردوکس می رسد، جریان افزایش می یابد. محصول واکنش احیاء بی رنگ و محصول واکنش اکسایش زرد رنگ می شود.
منبع: 512-514 (J.Muskin,M.Ragusa, T.Gelsthope, J.chem.Educ.87(2010
 کوه آتشفشان(آمونیوم دی کرومات)
کوه آتشفشان(آمونیوم دی کرومات) آمونیوم دی کرومات یک ماده ی معدنی نارنجی رنگ می باشد. آمونیوم دی کرومات به هنگام حرارت دادن تجزیه می شود یعنی همان واکنشی که در آزمایش کوه آتشفشان روی می دهد. واکنش تجزیه آمونیوم دی کرومات به صورت زیر است: NH4)2Cr2O7 => N2+Cr2O3+4H2O) که از تجزیه آمونیوم دی کرومات نارنجی رنگ،گاز نیتروژن،آب به صورت بخارو اکسید کروم به دست می آید. ...
 واکنش پتاسیم پرمنگنات و گلیسرین
واکنش پتاسیم پرمنگنات و گلیسرین پتاسیم پرمنگنات به عنوان یک اکسیدکننده قوی باعث سوختن گلیسیرین می شود و در اثر اختلاط این دو ماده آتش، خاکستر و کربن دی اکسید و بخار آب تولید می شود. خاکستر این واکنش شامل پتاسیم کربنات و منگنز اکسید می باشد. ...
.jpg) واکنش آب اکسیژنه و پتاسیم یدید(خمیر دندان فیل)
واکنش آب اکسیژنه و پتاسیم یدید(خمیر دندان فیل) ابتدا مقداری آب اکسیژنه را درون استوانه ی مدرج میریزیم سپس مقداری صابون مایع به ان اضافه میکنیم سپس محلولی از پتاسیم یدید تهیه ودر درون استوانه مدرج میریزیم که باعث میشود حجم زیادی کف تولید شود اما دلیل آن این است که یون I- کاتالیز گر واکنش تجزیه آب اکسیژنه است که باعث میشود به سرعت گاز اکسیژن تولید شود که باعث تولید کف فراوان میشود. ...
.jpg) واکنش آب وکلسیم کاربید وتولید استیلن
واکنش آب وکلسیم کاربید وتولید استیلن استیلن، یا اتین کوچکترین عضو خانوادهٔ آلکینهای هیدروکربنی است که از دو اتم هیدروژن و دو اتم کربن که با هم پیوند سهگانه دارند ساخته شدهاست. به خاطر وجود این پیوند سهگانه، استیلن جزو مواد شیمیایی اشباع نشده شناخته میشود استیلن در صنعت از اهمیت ویژهای برخوردار است. به عنوان ماده اولیه و پیش ماده در سنتز و تهیه مواد شیمیایی مختلف مورد نیاز میباشد. از این رو، روشهای صنعتی زیادی برای تولید انبوه این ماده ابداع شده است. این ماده قابل نگهداری و قابل حمل است ...
.jpg) رسوب کردن مس بر روی ورق رویی
رسوب کردن مس بر روی ورق رویی ابتدا محلولی از کات کبود را در بشر میریزیم سپس تیغه رویی را در بشر می گذاریم پس از نیم ساعت رنگ محلول از آبی به بی رنگ تبدیل میشود ومقداری رسوب مس بر روی تیغه ی رویی قرار میگرد که این واکنش به این علت است که مس از آلومینیوم در جدول استاندارد کاهشی پایین تر است ...
.jpg) سود سوزآور و کات کبود
سود سوزآور و کات کبود دراین فرآیند رنگ محلولی که در آن کات کبود بود آز آبی پر رنگ به آبی کم رنگ تغییر رنگ می دهد که این به این علت است که یک فرآیند جانشینی 2 گانه انجام میشود که مس(II)هیدروکسید و سدیم سولفات در این واکنش تولید میشوند ...
 برقکافت پتاسیم یدید
برقکافت پتاسیم یدید ابتدا لوله U شکل را به گیره متصل میکنیم سپس محلولی از پتاسیم یدید تهیه ودر لوله میریزیم سپس مقداری فنل فتالئین در لوله میریزیم سپس 2 درپوش را که از هرکدام الکترودی رد شده باشد را بر سر های لوله میگذاریم سپس باسیم های سر سوسماری الکترود ها را به قطب های باتری وصل میکنیم ...
1.jpg) تولید دود بنفش
تولید دود بنفش آلومینیوم با تشکیل یدید آلومینیوم وارد واکنش ید می شود. این یک واکنش اکسوترمی است، گرما آزاد شده، ید کریستال را گرم می کند و آن را خشک می کند، تشکیل یک بخار بنفش. ...
 خون آفریقایی
خون آفریقایی درگذشته قبایل افریقایی از این روش برای تولید خون مصنوعی استفاده میکردند ...
 کوه آتشفشان(آمونیوم دی کرومات)
کوه آتشفشان(آمونیوم دی کرومات) 


.jpg)
.jpg)
.jpg)
.jpg)
.jpg)

.jpg)

1.jpg)

.jpg)

